电解法制取有广泛用途的Na2FeO4,同时可以获得氢气。工作原理如图2所示,c(Na2FeO4)随初始c(NaOH)的变化如图3所示。
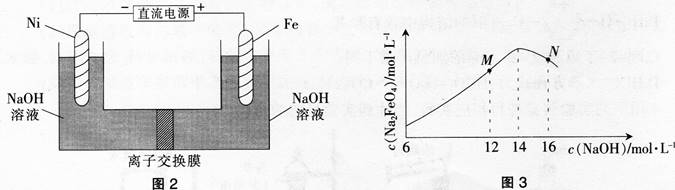
已知:FeO42-为紫红色;Na2FeO4只在强碱性条件下稳定,易被H2还原;溶液中OH-浓度过高,铁电极区会产生红褐色物质。下列说法错误的是( )。
- A.制备Na2FeO4的电极反应为<img src='http://tp.mxqe.com/data/440/18753373_0_1.png' alt='中学化学学科知识与教学能力,章节练习,基础复习,高级中学' title='中学化学学科知识与教学能力,章节练习,基础复习,高级中学'>
- B.电解过程中,须将阴极产生的气体及时排出
- C.图2中的离子交换膜为阴离子交换膜,电解过程中,阴极区附近pH会增大
- D.MN两点中c(Na2FeO4)低于最高值的原因不同,在M点会有Fe(OH)3生成
正确答案及解析
正确答案
D
解析
阳极上的铁失去电子和氢氧根离子反应生成高铁酸根离子和水,电极反应方程式为: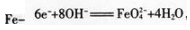
A项正确;镍电极上氢离子放电生成氢气,电极反应方程式为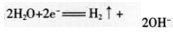 氢气具有还原性,根据题意Na:FeO4只有在碱性条件下稳定,易被氢气还原,因此在电解过程中,需将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低,B项正确;铁是阳极,电极反应方程式为:
氢气具有还原性,根据题意Na:FeO4只有在碱性条件下稳定,易被氢气还原,因此在电解过程中,需将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低,B项正确;铁是阳极,电极反应方程式为: Ni电极上氢离子放电,电极反应方程式为:
Ni电极上氢离子放电,电极反应方程式为: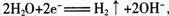
由此可知.阳极区消耗OH-,所以图2中的离子交换膜为阴离子交换膜,OH咱左向右移动,电解时阳极区pH降低。阴极区pH升高.C正确;Na2FeO4只有在碱性条件下稳定,在M点,c(OH-)较低,Na2FeO4稳定性差,且反应慢,在N点,c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4的产率降低,D项错误。故本题选D。
你可能感兴趣的试题
有“泥土诗人”之称的诗人是()。
-
- A.臧克家
- B.田间
- C.艾青
- D.许地山
- 查看答案
将下列各项按所表示年龄大小顺序排列,正确的顺序应是( )。
①不惑②垂髫③花甲④加冠⑤而立⑥古稀⑦半百
-
- A.②④①⑦⑤③⑥
- B.④②③⑥①⑦⑤
- C.⑥⑤③②④⑦①
- D.②④⑤①⑦③⑥
- 查看答案
明朝初年强化君主专制的措施是()。
-
- A.增设军机处
- B.采用三省六部制
- C.废除丞相.权分六部
- D.设中书省为全国最高行政机构
- 查看答案
钱穆在评论中国古代某制度时说,它“可以培植全国人民对政治之兴味……可以团结全国各地域于一个中央之统治”,这一制度是()。
-
- A.郡县制
- B.察举制
- C.科举制
- D.行省制
- 查看答案
1931年,一位给人们带来光明的科学家重病的消息牵动着世界人民的心,几十名记者为他守夜。每隔一个小时就对外发布一次消息:“灯”还亮着。这位科学家是( )。
-
- A.瓦特
- B.法拉第
- C.爱迪生
- D.爱因斯坦
- 查看答案